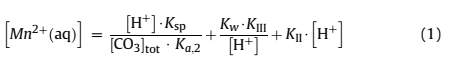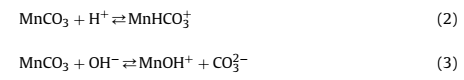 |  | |
|
УДК 622.321 Анализ процесса обработки высокомарганцевых шахтных вод известняком и карбонатом натрия
Головатенко Е.Л., ассистент Донбасская национальная академия строительства и архитектуры
Представлены результаты исследований осаждения марганца из шахтных вод с высоким содержанием марганца с применением карбоната натрия и известняковых смесей.
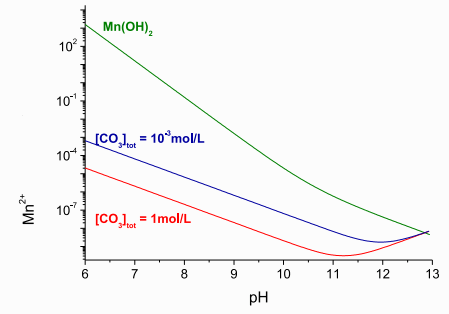
Известняк является наиболее распространенным нейтрализующим агентом для из-за его доступности, невысокой стоимости он будет первым вариантом для удаления металла из многих сточных вод. Был взят образец кальцитового известняка, в котором проанализировано 39,5% кальция и 1,23% магния. Этот образец сначала просеивали, а затем сушили в вибрационном стакане и оценивали распределение частиц по размерам с помощью лазерной дифракции, которая показала значения d50 и d90 5,6 мм и 18 мм, соответственно. Площадь поверхности известняка (1,52 м2/г) измеряли методом адсорбции Эксперименты по удалению марганца проводились с использованием синтетических растворов, а также с шахтной водой. Часть периодических экспериментов проводили с кальцитовым известняком, смешанным с карбонатом натрия (Na2CO3); другая часть выполняется смесью либо с бикарбонатом (NaHCO3), либо с гидроксидом натрия. Изучены синтетические растворы, содержащие 140-2000 мг/дм3 марганца (MnCl2 . 4H2O), приготовленные при рН 2,3-6,5. Эксперименты были завершены пробой шахтной воды с анализом 140,0 мг/дм3 марганца и рН 6,5. Объем раствора 120 мл (синтетическая или шахтная вода) переносили в 250 мл раствора Эрленмейера и смешивали с различными количествами известняка (4,2-20,8 г/дм3) и карбоната натрия (0,39-0,92 г/дм3). Колбы выдерживали при перемешивании (450 мин-1) в течение 90 мин при 23°С. Когда эксперименты были закончены, фиксировали значение рН, твердую фазу фильтровали и анализировали водный раствор на марганец. Эффект времени на осаждение марганца определяли в 2,0 дм3 открытого раствора Эрленмейера, где 1,5 дм3 раствора марганца смешивали с известняком (12,5 г/дм3) и карбонатом кальция (0,67 г/дм3) при рН 6,5 (начальное значение). Эти колбы перемешивали при 450 мин-1, 232°С и образцы отбирали каждые 5 мин для определения марганца [1]. Непрерывные эксперименты проводили в реакторе с мешалкой с емкостью 1,67 дм3 при 232о С. Подавали отдельно с 140 мг/дм3 марганцевой шахтной водой или синтетическими растворами марганца и смесью из известняка (12,5 г/дм3) и карбоната натрия (0,67 г/дм3). Один эксперимент проводили только с карбонатом натрия (с той же концентрацией); т. е. в отсутствие известняка. Скорость перемешивания устанавливали на уровне 1200 мин-1 и обеспечивали два перистальтических насоса, один из которых подавал раствор марганца со скоростью 24,0 мл/мин, а второй - смесь карбоната известняка (4,0 мл/мин). Время пребывания было установлено 60 минут и эксперименты проводились в течение 9 часов, чтобы обеспечить стабильность состояния. Через каждые 60 минут аликвоту отбирали из реактора, фильтровали и определяли содержание марганца и рН. Твердый остаток был сохранен для дальнейшего анализа. До и во время экспериментов шахтная вода хранилась в пластиковых контейнерах при комнатоной температуре. Марганец может быть удален как с шахтных вод, так и с промышленных сточных вод в виде различных соединений, а форма удаления определяется химическими свойствами воды, особенно значения pH [2]. В окислительных условиях образуются оксигидроксиды марганца, в то время как марганцеподобные карбонатные минералы, такие как родохрозит (MnCO3) и кутнахорит (CaMn (CO3)2), наблюдаются, чтобы естественным образом осаждаться в присутствии ионов карбоната, если рН в диапазоне 7-11 (рисунок 1a). На рисунке 1 представлена растворимость марганца при рассмотрении осаждения карбоната или гидроксида марганца. Растворимость карбоната марганца рассчитывали по уравнению (1), где были учтены комплексы MnHCO3 и MnOH2 вместе с суммарными концентрациями карбоната
где [H+] - концентрация ионов водорода; [CO3]- общее количество растворенных карбоновых видов; Kspк - константа произведения растворимости; KII и KIII - константы равновесия уравнений (2) и (3), соответственно; Ka, 2- вторая константная диссоциация H2CO3; Kw – ионный произведение воды.
Рис. 1 – Схема растворимости карбоната марганца и гидроокиси в зависимости от рН
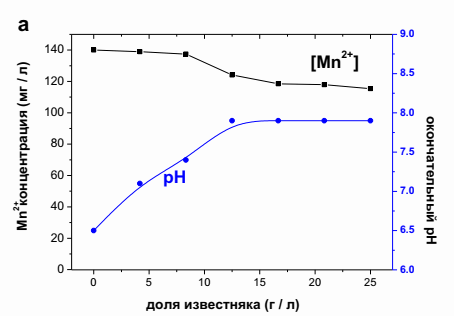
Уравнение (1) показывало довольно точно водные концентрации марганца в равновесии с карбонатом марганца. Также на рисунке 1 представлена теоретическая растворимость гидроксида марганца при 25 ° С. В присутствии ионов карбоната (10-3 моль/л растворенного карбоната) и значений рН выше 8 концентрация марганца снижалась до значений ниже 105 моль/л. Для достижения такой же остаточной концентрации при осаждении гидроксида требовалось значение рН 10 или выше. Поэтому осаждение карбоната обеспечивало более низкие остаточные концентрации марганца в нейтральных значениях рН по сравнению с удалением гидроксида металла [3]. Это наблюдение согласуется с выводами, которые заявили, что щелочность является одним из наиболее рентабельных методов удаления марганца из шахтных вод. Еще один результат, продемонстрированный на рисунке 1, состоял в том, что осаждение карбонатов позволило упростить соответствие нормативным требованиям, так как большинство стран определяют рН 9 как максимально допустимое значение для сброса шахтной воды. Таким образом, была изучена комбинация известняковых и растворимых карбонатных источников. Эксперименты с синтетическими растворами проводились для определения количества порошка известняка (<45 мм) и карбоната натрия, необходимого для удаления марганца из синтетического марганца 140 мг/дм3. На рисунке 2а можно заметить, что только один известняк не удалял марганец эффективно при таких высоких концентрациях. В то время как рН повышался до 7,9, концентрация Mn2+ снижалась до 120 мг/дм3, когда использовалось 25 г/дм3 известняка (рисунок 2а), что эквивалентно поглощению марганца 0,98 мг Mn2+/г-известняка. В предыдущем исследовании было обнаружено, что это было связано с сорбцией марганца на карбонате кальция. Авторы также наблюдали увеличение рН при удалении марганца и аналогичном поглощении марганца (1,28 мг Mn2+ / г-известняка) [4].
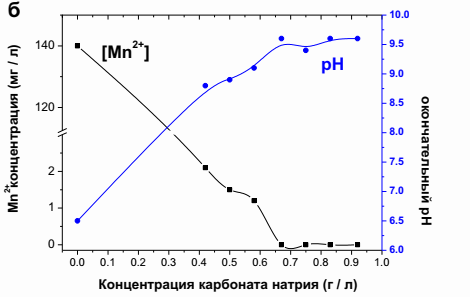
В отличие от порошкообразного известняка, карбонат натрия интенсивно осаждал марганец (рисунок 2б), как и ожидалось. В присутствии 0,67 г/дм3 карбоната натрия рН раствора достигал 9,6, а концентрация марганца была снижена до значений ниже предела детекции синтетическим раствором. Экспериментальные условия: 140,0 мг/дм3 исходного рН 6,5. Концентрации нижних карбонатов дают более низкие конечные значения рН и, следовательно, более высокие остаточные концентрации марганца в водной фазе, как показано на рисунке 1б [5]. Эти результаты согласуются с исследованиями во время удаления марганца из продуктов, полученных в гидрометаллургических операциях, что также показало, что для получения остаточных марганца ниже 1 мг/дм3 необходимо значение рН выше 8,0.
1 Рис. 2 - Влияние доли порошка известняка (а) и концентрации карбоната натрия (б) на удаление марганца из синтетических растворов.
Библиографический список
| ||
 | 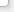 |
#menuinclude(1-elibraryru)